- 网站首页
- 关于我们
- 产品中心
- 重组蛋白和细胞因子
- ART101S 重组人白蛋白 (超纯,固体)
- ART101L 重组人白蛋白 (超纯,液体)
- ART102L 重组人白蛋白(超纯,液体)
- ART103L重组人白蛋白(高纯,液体)
- ART103S 重组人白蛋白(高纯,固体)
- ART201S 重组人转铁蛋白(脱铁,干粉)
- ART202S重组人转铁蛋白(全铁,干粉)
- CK1013S 重组人碱性成纤维细胞生长因子bFGF
- CK101302S热稳定重组人碱性成纤维细胞生长因子HSbFGF
- CK1001 重组人白介素2 IL2
- CK1002S 重组人白介素15 IL15
- CK1024 重组人血管内皮生长因子VEGF165
- RP1001S重组人粘连蛋白片段 FN(高纯,固体)
- RP100402L重组人玻连蛋白(VTN-N)
- 更多
- 抗体
- 蛋白纯化设备&磁珠
- PP24高通量自动化蛋白纯化工作站
- PP32高通量自动化蛋白纯化工作站
- PP96高通量自动化蛋白纯化工作站
- MG101 MG102 Protein A 磁珠
- MG201 MG202 Protein G 磁珠
- MG301 MG302 Ni NTA磁珠
- MG401 MG402 耐碱 耐EDTA Ni TED磁珠
- MG501 MG502 耐碱 Protein A磁珠
- MG601 MG602重组蛋白 L磁珠
- MG701 MG702GSH磁珠(GSH Magnetic Beads)
- MG801 MG802 Strep Tactin磁珠(Strep Tactin Magnetic Beads)
- MG901 MG902 肝素磁珠(Heparin Magnetic Beads)
- MG1001 MG1002 抗HA磁珠(anti-HA Magnetic Beads)
- MG1101 MG1102 抗 Myc (Anti-c-Myc)磁珠
- Cryo-SFI无血清细胞冻存液
- 高效电转化感受态细胞
- 重组蛋白和细胞因子
- CRO服务
- 新闻资讯
白细胞介素‐7(IL7)的结构、功能以及主要应用
白介素‐7(IL-7)是一种约25 kDa的可溶性Ⅰ型细胞因子,结构预测为典型的四螺旋束构象。人IL7基因位于8号染色体长臂的21.13区(即8q21.13)。IL-7受体为异二聚体,由IL-7Rα(CD127)与共用γ链(CD132)组成。IL-7与受体结合后,促使受体关联的Janus激酶JAK1和JAK3激活,进而磷酸化并激活STAT5;同时激活PI3K–Akt和Src激酶等信号通路。下游STAT5进入细胞核,调控靶基因表达,显著上调抗凋亡因子Bcl-2、Bcl-xL、Mcl-1等的表达,并抑制促凋亡的Bax、Bim、Bad等分子。这一系列信号通路协调起保护性作用,促进淋巴细胞的增殖与存活。
IL-7结合IL-7Rα/γc受体后激活JAK1/JAK3→STAT5以及PI3K→Akt等通路,诱导Bcl-2家族抗凋亡蛋白表达,抑制促凋亡蛋白(如Bax、Bad、Bim)表达。

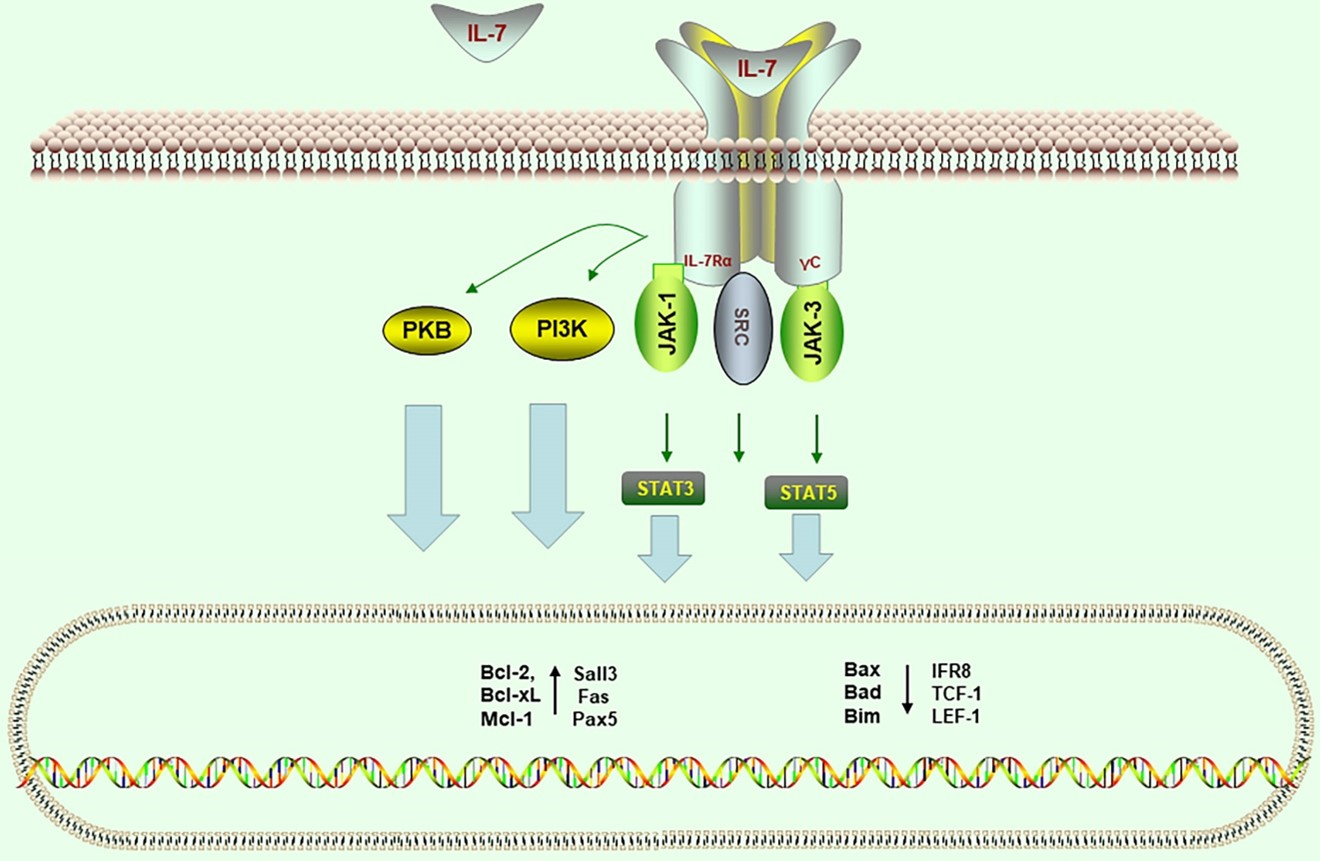

图1 IL-7受体(IL-7Rα/CD127 + γ链)信号转导示意图。IL-7结合后激活JAK1/JAK3和PI3K-Akt/STAT5等通路,引发抗凋亡基因(Bcl-2、Bcl-xL、Mcl-1等)表达增多。
白介素‐7的生物学作用
IL-7在淋巴细胞发育中发挥关键作用。胚胎及造血基质细胞分泌IL-7,调节T细胞和B细胞的分化和增殖。在小鼠中,缺失IL-7或IL-7受体会导致严重的T细胞生成障碍,表现为胸腺细胞数量减少和T/B细胞发育受阻;同样,人类IL-7Rα缺陷可引起T^-B^+NK^+型SCID(严重联合免疫缺陷)。IL-7还参与早期淋巴细胞基因重排过程(促进TCRγ、TCRβ和Ig重链重排),对T/B细胞谱系的形成至关重要。
在外周,IL-7是维持成熟T细胞存活和功能的关键因子。IL-7促进外周成熟T细胞(尤其是Naïve和中心记忆T细胞)的生存和稳态增殖;IL-7敲除小鼠外周T细胞显著减少。IL-7通过诱导抗凋亡分子(如Bcl-2家族)和提高葡萄糖摄取来增强T细胞活力。研究表明,IL-7能够促进T细胞表面葡萄糖转运体GLUT1的转移和功能,从而增强葡萄糖摄取以满足能量需求。这一过程依赖STAT5介导的Akt激活:IL-7首先激活STAT5转录活性,继而上调Akt,双重作用最终使GLUT1转运到细胞表面,从而提高细胞对葡萄糖的摄取并防止凋亡。
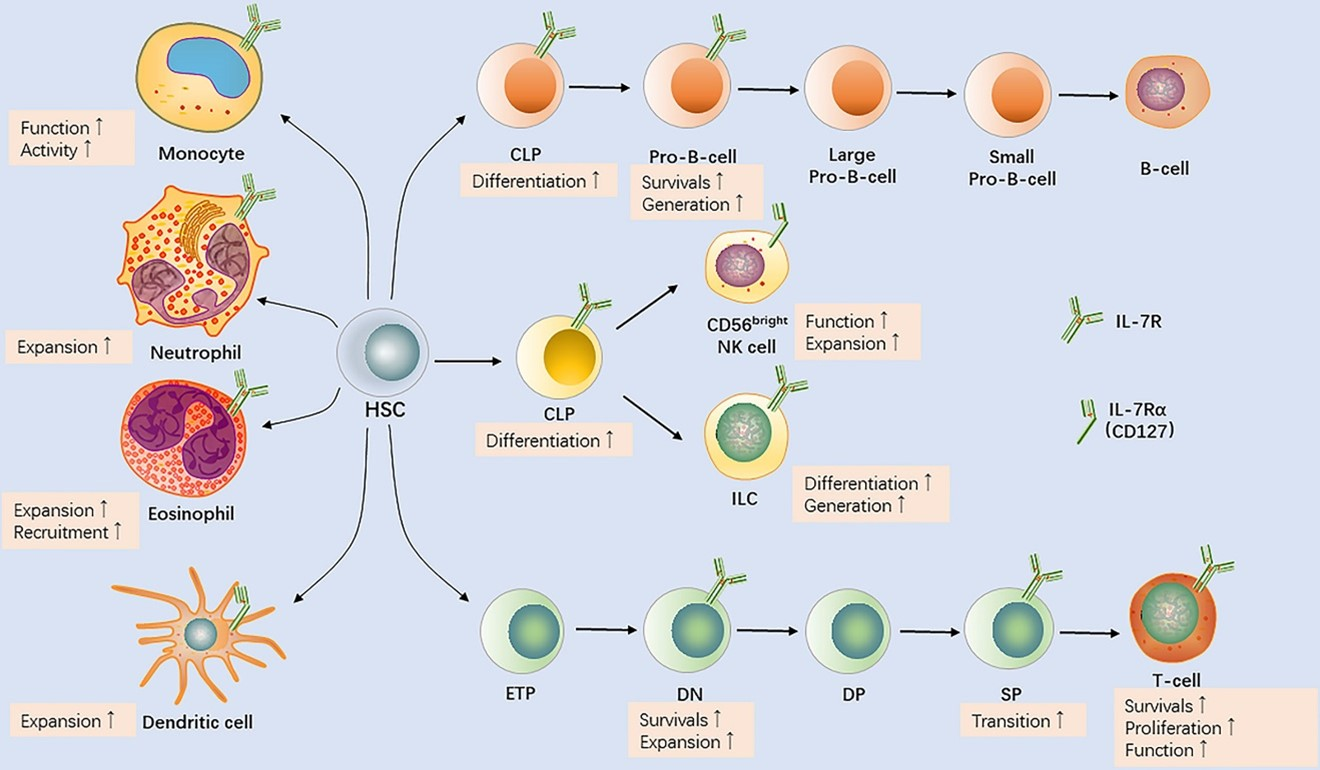
此外,IL-7对T细胞记忆形成和免疫记忆维持也很重要。IL-7信号缺失会损害记忆型CD4^+和CD8^+ T细胞的产生和存续。总体而言,IL-7通过协调细胞增殖、抗凋亡和能量代谢等多种机制,对T细胞(以及在某种程度上B细胞)的生存、稳态和免疫记忆形成起着不可替代的作用。
白介素‐7在细胞培养中的应用
在体外细胞培养体系中,IL-7常作为重要的生长因子使用,尤其用于T细胞、CAR-T细胞和调节性T细胞的扩增。与传统的IL-2培养相比,加入IL-7及其他γ链细胞因子(如IL-15)的培养方案可显著提高细胞扩增率和存活率,同时维持较少分化的表型。例如,有研究发现,B/I激活的特异性T细胞在IL-7/IL-15培养条件下增殖速度更快,最终活细胞产量是IL-2培养的5–10倍,且含有更多CD8^+中央记忆表型细胞。IL-2和IL-7的协同作用对活化CD4^+ T细胞增殖和存活十分有利;另一项研究还显示,用IL-7和IL-15替代IL-2培养人Treg细胞,可获得更高的扩增倍数和细胞产量(IL-7/15方案14天下来扩增716倍 vs IL-2方案323倍),存活率也明显提高。
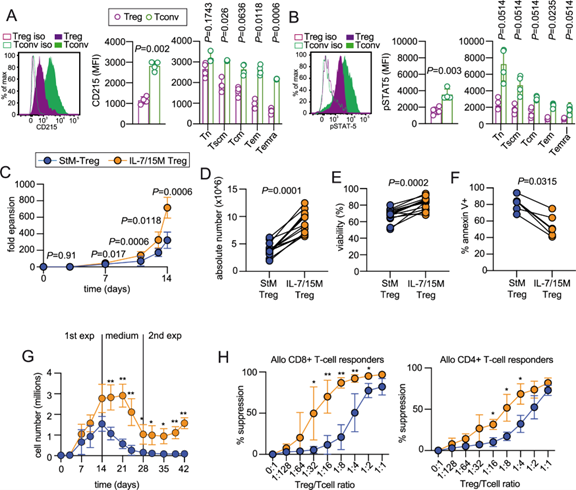
图3 Treg 表达功能性 IL-15 受体 α 链 (CD215) 并响应 IL-7 和 IL-15 的组合而增殖
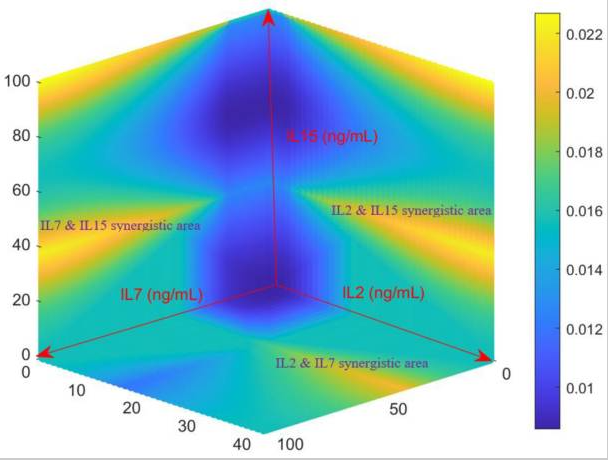
图4 模型预测的不同细胞因子组合下活化CD4 + T细胞的生长率(单位: hr )。该模型在生长研究中考察的整个浓度空间内进行评估,并生成了该图谱,其中包含所有可能的IL-2组合。IL-2∈ [0–40 ng/mL],IL-7∈[0–100 ng/mL]和 IL-15∈[0–100 ng/mL]。右侧显示了以 (hr −1 ) 为单位的生长速率刻度,黄色代表增殖最快,深蓝色代表增殖最慢。
细胞因子组合培养:研究表明IL-2与IL-7具有协同作用,二者共同存在时能促进CD4^+ T细胞增殖和存活;加入IL-15的三因子体系亦能进一步提高扩增效果。
IL-7+IL-15培养:IL-7与IL-15联合培养获得的T细胞扩增效率和产量均显著优于单用IL-2。例如,在抗原激活的T细胞扩增实验中,IL-7/IL-15培养得到的细胞扩增速度更快、总产量更高,且具有更多的中心记忆(CD62L^+CD45RA^-)表型。
增强存活性:IL-7/IL-15培养的人Treg细胞在14天扩增终点时,活细胞率达82%,远高于传统IL-2培养(68%);而且IL-7/15培养的Treg对凋亡刺激(如Fas抗体)更具抵抗力,凋亡率显著降低。
CAR-T细胞培养:在CAR-T体外制备过程中添加IL-7,可富集更多干细胞样的记忆T细胞群体并减少耗竭标志物的表达。一项研究表明,不经CD3激活而仅用IL-7培养的CD19 CAR-T细胞(“NICE CAR-T”)在扩增后表现出更多的记忆干细胞表型(CD45RA^+CCR7^+CD95^+)、更低的PD-1/LAG-3耗竭标志物表达,以及更强的增殖潜能。
这些结果提示,在体外扩增和制备免疫细胞时,IL-7联合使用可以有效提高细胞产量、延长存活并维持更佳的免疫表型,为细胞治疗制剂的优化提供了重要手段。
白介素‐7在细胞治疗中的应用
在细胞免疫治疗中,IL-7作为辅助因子受到广泛关注,可增强过继转移细胞(CAR-T、TIL、TCR-T等)的效能并促进淋巴细胞再生:
CAR-T细胞:将IL-7基因与CAR结构融合的策略可显著提高CAR-T的功能与持久性。比如,将IL-7融入B7-H3靶向CAR结构的细胞中,使CAR-T细胞在体外扩增后表现出更强的增殖能力和持续的细胞毒性,同时其表面PD-1、LAG-3等耗竭标志物表达降低。此外,给体内接受CAR-T治疗的模型小鼠注射长效IL-7(如与Fc融合的rhIL-7-hyFc)可大幅增强CAR-T细胞的扩增、在体存留和抗肿瘤活性,使小鼠获得长期无瘤存活。
联合免疫增强策略:IL-7与免疫检查点抑制剂联用已成为研究热点。在上述B7-H3 CAR-T研究中,IL-7共表达组中T细胞表面PD-1和LAG-3水平明显降低,提示IL-7可减轻CAR-T细胞的耗竭状态。临床上正在探索长效IL-7(如efineptakin alfa/NT-I7)与抗PD-1抗体联合治疗实体瘤的疗效,已有早期结果显示此组合可显著增加肿瘤部位的淋巴细胞浸润并提升免疫应答(相关临床试验如NT-I7+pembrolizumab组合正在进行中)。
淋巴细胞减少状态下的再生:对于淋巴细胞严重耗竭或免疫低下的患者,IL-7可以促进淋巴细胞的再生和恢复。动物模型研究显示,在经过淋巴细胞去plete的肿瘤小鼠体内使用IL-7-Fc融合蛋白能够显著增强过继转移CD8^+ T细胞在肿瘤组织及肿瘤引流淋巴结的扩增和滞留,抑制肿瘤生长。在临床上,对COVID-19导致严重淋巴细胞减少的危重患者进行随机对照试验发现,注射重组人IL-7(Cyt107)安全耐受良好,可显著增加患者外周血淋巴细胞计数,并使医院获得性感染事件率明显下降。类似地,其他研究表明IL-7治疗可以促进造血干细胞移植后或长期抗病毒治疗(如HIV抗逆转录病毒治疗)患者的T细胞恢复与存活。
其他细胞疗法:IL-7也被应用于TIL和TCR-T等治疗的研发中。如有研究在体外扩增Tregs时添加IL-7/IL-15以改善扩增效果。虽然直接针对TIL疗法的IL-7研究较少,但IL-7在上文所述的CAR-T、TCR-T等“过继转移”疗法中的促进作用亦具有启示意义。
综上,IL-7作为一种强大的免疫辅因子,在多种细胞免疫治疗策略中显示出提升细胞存活性、功能性和持久性的潜力。当前许多临床前研究和临床试验(如CAR-T细胞共表达IL-7/CCL19并联合PD-1抗体治疗方案)正在评估IL-7与其它免疫治疗手段的联合应用,以期在癌症和免疫缺陷相关疾病中发挥协同效应。
参考资料:
Chen D, Tang TX, Deng H, Yang XP, Tang ZH. Interleukin-7 Biology and Its Effects on Immune Cells: Mediator of Generation, Differentiation, Survival, and Homeostasis. Front Immunol. 2021 Dec 2;12:747324. doi: 10.3389/fimmu.2021.747324. PMID: 34925323; PMCID: PMC8674869.
Wofford JA, Wieman HL, Jacobs SR, Zhao Y, Rathmell JC. IL-7 promotes Glut1 trafficking and glucose uptake via STAT5-mediated activation of Akt to support T-cell survival. Blood. 2008 Feb 15;111(4):2101-11. doi: 10.1182/blood-2007-06-096297. Epub 2007 Nov 27. PMID: 18042802; PMCID: PMC2234050.
Cha E, Graham L, Manjili MH, Bear HD. IL-7 + IL-15 are superior to IL-2 for the ex vivo expansion of 4T1 mammary carcinoma-specific T cells with greater efficacy against tumors in vivo. Breast Cancer Res Treat. 2010 Jul;122(2):359-69. doi: 10.1007/s10549-009-0573-0. Epub 2009 Oct 14. PMID: 19826947; PMCID: PMC4033304.
Coppola C, Hopkins B, Huhn S, Du Z, Huang Z, Kelly WJ. Investigation of the Impact from IL-2, IL-7, and IL-15 on the Growth and Signaling of Activated CD4+ T Cells. Int J Mol Sci. 2020 Oct 22;21(21):7814. doi: 10.3390/ijms21217814. PMID: 33105566; PMCID: PMC7659484.
Filoni J, Ferrari A, Jofra T, Putignano AR, Da Dalt L, Cesarano S, Di Dedda C, Bonacina F, Marchesi F, Norata GD, Bonini C, Piemonti L, Monti P. Metabolic reprogramming of naïve regulatory T cells by IL-7 and IL-15 promotes their persistence and performance upon adoptive transfer. Commun Biol. 2025 Jan 21;8(1):99. doi: 10.1038/s42003-024-07381-1. Erratum in: Commun Biol. 2025 Feb 23;8(1):295. doi: 10.1038/s42003-025-07637-4. PMID: 39838096; PMCID: PMC11751088.
Wang SY, Scurti GM, Dalheim AV, Quinn S, Stiff PJ, Nishimura MI. Nonactivated and IL-7 cultured CD19-specific CAR T cells are enriched in stem cell phenotypes and functionally superior. Blood Adv. 2024 Jan 23;8(2):324-335. doi: 10.1182/bloodadvances.2023010607. PMID: 37967375; PMCID: PMC10788799.
Wu H, Xu Z, Qi M, Liu P, Zhang B, Wang Z, Chen G, Liu X, Liu J, Wei W, Duan W, Chen Z. Interleukin-7 expression by CAR-T cells improves CAR-T cell survival and efficacy in chordoma. Cancer Immunol Immunother. 2024 Aug 2;73(10):188. doi: 10.1007/s00262-024-03756-9. PMID: 39093440; PMCID: PMC11297017.
Kim MY, Jayasinghe R, Devenport JM, Ritchey JK, Rettig MP, O'Neal J, Staser KW, Kennerly KM, Carter AJ, Gao F, Lee BH, Cooper ML, DiPersio JF. A long-acting interleukin-7, rhIL-7-hyFc, enhances CAR T cell expansion, persistence, and anti-tumor activity. Nat Commun. 2022 Jun 13;13(1):3296. doi: 10.1038/s41467-022-30860-0. PMID: 35697686; PMCID: PMC9192727.
Yu EM, Cho E, Singh R, Kim SH, Han C, Han S, Lee DG, Kim YH, Kwon BS, Choi BK. IL7-Fc Enhances the Efficacy of Adoptive T Cell Therapy under Lymphopenic Conditions in a Murine Melanoma Model. Cells. 2021 Aug 7;10(8):2018. doi: 10.3390/cells10082018. PMID: 34440787; PMCID: PMC8392867.
Shankar-Hari M, Francois B, Remy KE, Gutierrez C, Pastores S, Daix T, Jeannet R, Blood J, Walton AH, Salomao R, Auzinger G, Striker D, Martin RS, Anand NJ, Bosanquet J, Blood T, Brakenridge S, Moldawer LL, Vachharajani V, Yee C, Dal-Pizzol F, Morre M, Berbille F, van den Brink M, Hotchkiss R. A randomized, double-blind, placebo-controlled trial of IL-7 in critically ill patients with COVID-19. JCI Insight. 2025 Feb 4;10(6):e189150. doi: 10.1172/jci.insight.189150. PMID: 39903535; PMCID: PMC11949036.
CRO热线:13031023698
产品热线:13051765615
邮箱:support@sciprotech.com













