- 网站首页
- 关于我们
- 产品中心
- 重组蛋白和细胞因子
- ART101S 重组人白蛋白 (超纯,固体)
- ART101L 重组人白蛋白 (超纯,液体)
- ART102L 重组人白蛋白(超纯,液体)
- ART103L重组人白蛋白(高纯,液体)
- ART103S 重组人白蛋白(高纯,固体)
- ART201S 重组人转铁蛋白(脱铁,干粉)
- ART202S重组人转铁蛋白(全铁,干粉)
- CK1013 重组人碱性成纤维细胞生长因子bFGF
- CK101302S热稳定重组人碱性成纤维细胞生长因子HSbFGF
- CK1001 重组人白介素2 IL2
- CK1002S 重组人白介素15 IL15
- CK1024 重组人血管内皮生长因子VEGF165
- RP1001S重组人粘连蛋白片段 FN(高纯,固体)
- RP100402L重组人玻连蛋白(VTN-N)
- 更多
- 抗体
- 蛋白纯化设备&磁珠
- PP24高通量自动化蛋白纯化工作站
- PP32高通量自动化蛋白纯化工作站
- PP96高通量自动化蛋白纯化工作站
- MG101 MG102 Protein A 磁珠
- MG201 MG202 Protein G 磁珠
- MG301 MG302 Ni NTA磁珠
- MG401 MG402 耐碱 耐EDTA Ni TED磁珠
- MG501 MG502 耐碱 Protein A磁珠
- MG601 MG602重组蛋白 L磁珠
- MG701 MG702GSH磁珠(GSH Magnetic Beads)
- MG801 MG802 Strep Tactin磁珠(Strep Tactin Magnetic Beads)
- MG901 MG902 肝素磁珠(Heparin Magnetic Beads)
- MG1001 MG1002 抗HA磁珠(anti-HA Magnetic Beads)
- MG1101 MG1102 抗 Myc (Anti-c-Myc)磁珠
- Cryo-SFI无血清细胞冻存液
- 高效电转化感受态细胞
- 重组蛋白和细胞因子
- CRO服务
- 新闻资讯
癌症治疗最近的重大研究进展
近日,美国加州大学戴维斯分校综合癌症中心的Mondal T团队确定了CD95受体上一个可导致细胞死亡的关键表位。这种触发细胞程序性死亡的新能力可能会为改进癌症治疗打开大门。这一发现发表在近期《自然》杂志旗下的《细胞死亡与分化》杂志上,论文题目:Characterizing the regulatory Fas (CD95) epitope critical for agonist antibody targeting and CAR-T bystander function in ovarian cancer。
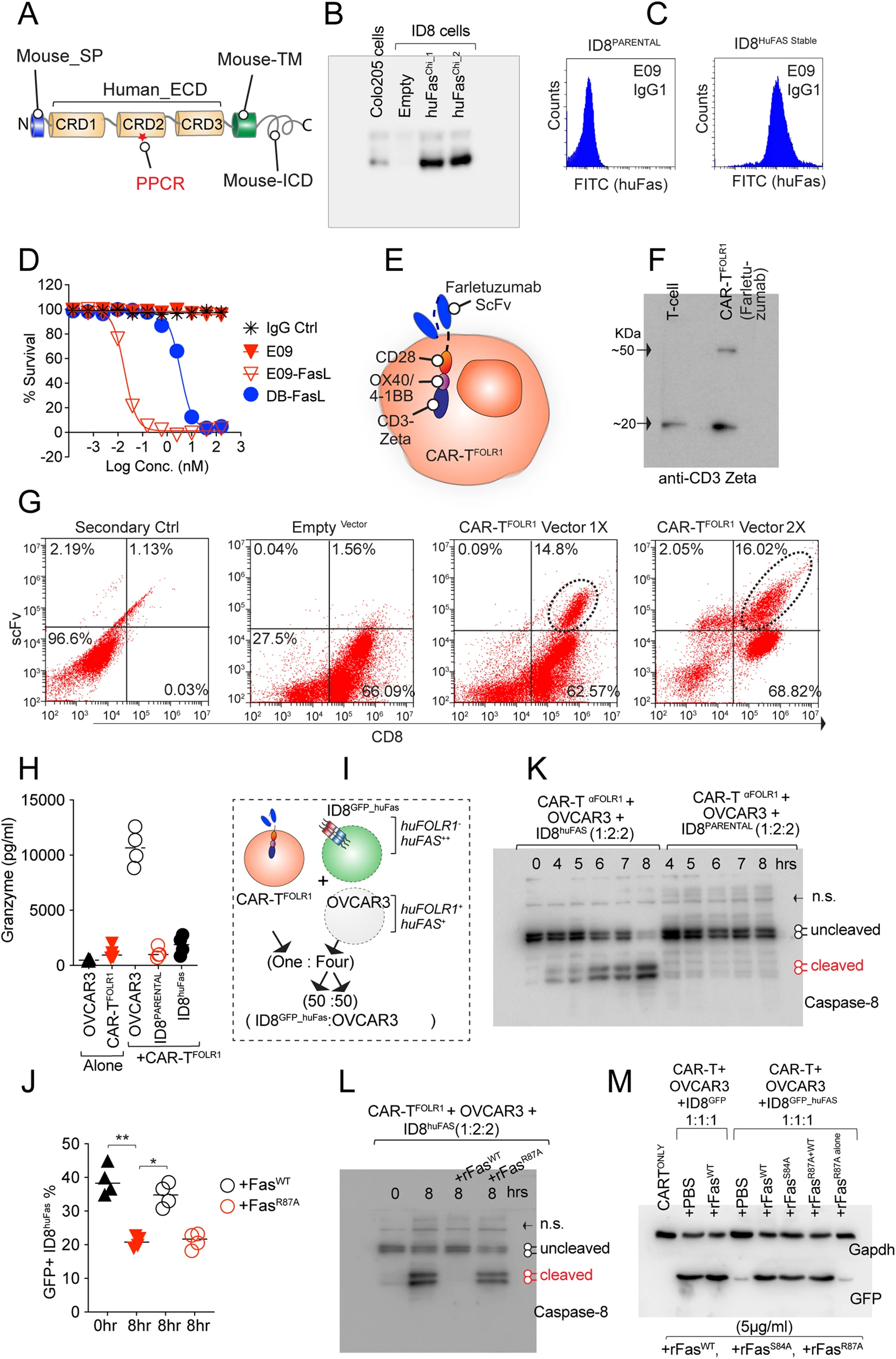
Fig. 8: Fas PPCR R87 is critical for CAR-T bystander function.(论文原图)
CD95受体,也被称为Fas,是一种死亡受体。这些蛋白质受体位于细胞膜上,当被激活时,它们会释放出导致细胞自毁的信号。调节Fas也可能将嵌合抗原受体T细胞免疫疗法(CAR-T)的好处扩展到卵巢癌等实体肿瘤。
研究人员表示,他们找到了细胞毒性Fas信号以及CAR-T抗肿瘤功能的最关键表位。这可能会提供一条以肿瘤中的Fas为靶点的治疗途径。死亡受体的作用正如其名字所暗示的那样,当被定位时,它们会触发肿瘤细胞的程序性死亡。它们提供了一种潜在的变通办法,可同时杀死肿瘤细胞,并为更有效的免疫疗法铺平道路。动物模型和人类临床试验等其他研究表明,Fas信号是CAR-T成功的基础,特别是在遗传异质性的肿瘤中。遗传异质性肿瘤混合了不同类型的细胞,对治疗的反应可能不同。Fas激活剂可能会产生CAR-T旁观者效应。换句话说,激活Fas可能会摧毁癌细胞,并提高CAR-T的疗效,这是一种潜在的对抗肿瘤的双重打击方法。
近日来,不断传来关于癌症治疗的突破性消息。据参考消息网援引英国《泰晤士报》网站10月22日报道,科学家已取得20年来宫颈癌治疗方面的最大突破。在英国,这将每年挽救数百名女性的生命。伦敦大学学院领导的一项国际试验发现,更好地使用现有药物将把因罹患这种疾病而过早死亡的风险降低35%。始于1999年的标准疗法是一个疗程的放化疗(CRT),即将化疗与放疗相结合。然而,上述涉及500名患者的试验发现,在开始CRT前进行为期6周的化疗大大提高了患者的生存几率。领导这项试验的伦敦大学学院癌症研究所的玛丽·麦科马克博士说:“我们的试验表明,在进行这种短期附加化疗后立即进行标准CRT可将癌症复发或过早死亡的风险降低35%。”她说:“这是20多年来在治疗这种疾病方面的最大改进。”

鳞状细胞癌(最常见的宫颈癌类型)的放大图像。 美国国家癌症研究所(NCI)
中国医学科学院生物医学工程研究所等团队最新开发了一种新型人血清白蛋白药物递送体系,该体系显著提高了药物负载率,实现了抗肿瘤药物的主动靶向递送和肿瘤的高效光热治疗。近日,该研究成果在国际著名学术期刊《自然·通讯》上发表。该研究开发了一种新型人血清白蛋白药物递送体系,用于高效负载具有双马来酰亚胺结构的近红外染料,实现了抗肿瘤药物的主动靶向递送。相比于此前的人血清白蛋白药物递送体系,该技术显著提高了药物负载率,达到26.1%,并在体外表现出了增强的细胞摄取和3D肿瘤球渗透能力。此外,体内研究亦表明该体系具有良好的靶向效率,可作为一种新型光热治疗体系用于光热消融肿瘤。研究团队表示,新型药物递送系统的药物负载模式,有望用于实现更多的具有双马来酰亚胺结构药物的高效负载和靶向递送,以提高药物递送效率,将为癌症和其它疾病的治疗药物的负载提供重要思路。

a Fabrication processes of BPY@HSA by the bridging strategy. b Therapeutic functions of BPY@HSA. c Schematic illustration of photoacoustic imaging and PTT on tumor model. Created with BioRender.com.(论文原图)
参考文献
1. Mondal T, Gaur H, Wamba BEN, et al. Characterizing the regulatory Fas (CD95) epitope critical for agonist antibody targeting and CAR-T bystander function in ovarian cancer [published online ahead of print, 2023 Oct 14]. Cell Death Differ. 2023;10.1038/s41418-023-01229-7. doi:10.1038/s41418-023-01229-7
2. Shi Z, Luo M, Huang Q, et al. NIR-dye bridged human serum albumin reassemblies for effective photothermal therapy of tumor. Nat Commun. 2023;14(1):6567. Published 2023 Oct 17. doi:10.1038/s41467-023-42399-9
CRO热线:13031023698
产品热线:13051765615
邮箱:support@sciprotech.com













